19 февраля 2019 г. (GLOBE NEWSWIRE). Spectral объявляет об одобрении FDA США испытания TIGRIS
ТОРОНТО, 19 февраля 2019 г. (GLOBE NEWSWIRE) - Spectral Medical Inc. («Spectral» или «Компания») (TSX: EDT), компания, участвующая в III фазе клинических испытаний, разрабатывающая первое лечение для пациентов с эндотоксическим септическим шоком под контролем диагностики, сегодня объявила о том, что FDA США было одобрено клиническое исследование TIGRIS в качестве дополнения к оригинальным первичным результатам исследования EUPHRATES и, как таковое, его результаты будут добавлены к данным исследования EUPHRATES. Пациенты будут включены в исследование TIGRIS с использованием тех же критериев включения, что были у пациентов, показавших клинически значимое снижение смертности в рамках исследования EUPHRATES.
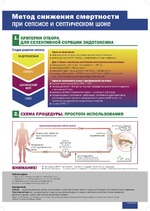
TIGRIS будет использовать ту же первичную конечную точку 28-дневной смертности, ожидается, что в исследование будут включены 150 пациентов с септическим шоком с баллом MODS > 9 и уровнями активности эндотоксина (EAA) между 0,60 и 0,90. Пациенты будут рандомизированы в соотношении 2:1 для группы лечения по сравнению с контрольной группой, исследование будет открытым. В исследовании будет использован байесовский статистический подход для объединения данных из исследования EUPHRATES с данными из испытания TIGRIS. TIGRIS будет проводиться исключительно в больницах США, где уже есть опыт использования картриджа PMX, и которые показали хороший уровень участия в исследовании EUPHRATES.
«Компания провела тщательные интерактивные согласования с FDA США, чтобы определить оптимальный путь дальнейшего продвижения картриджа Toraymyxin™ («PMX»), - сказал доктор Пол Уокер, президент и главный исполнительный директор Spectral. «Мы удовлетворены рекомендациями FDA США и уверены в программе, которую мы разработали, чтобы продемонстрировать эффективность и безопасность для поддержки будущей заявки на одобрение этого потенциально жизнесберегающего лечения. Частота возникновения сепсиса и септического шока в Соединенных Штатах продолжает расти и по-прежнему имеет неприемлемо высокий уровень смертности, который, как было показано, в этой группе пациентов превышает 40%.
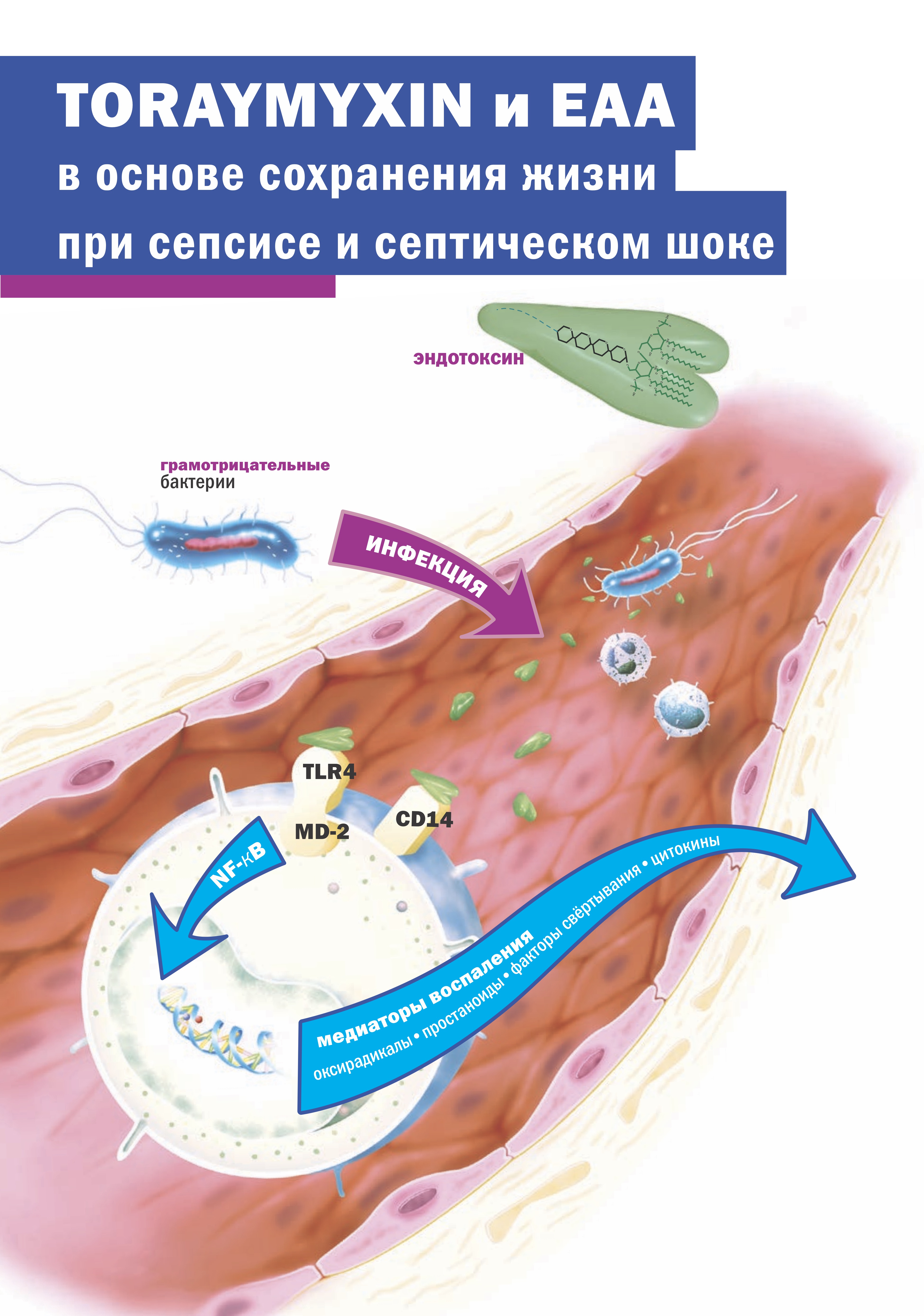
Мы ожидаем, что исследование TIGRIS начнет регистрацию пациентов в ближайшем будущем и предоставит необходимые данные об эффективности и безопасности для применения колонки Toraymyxin (PMX) у пациентов с септическим шоком. Выявление пациентов, наиболее склонных к ответу на это лечение, на основе знаний, полученных в ходе исследования EUPHRATES, остается уникальным аспектом этого исследования. Испытание EUPHRATES продемонстрировало, что когда активность эндотоксина находилась в критическом диапазоне лечения от 0,6 до 0,9, наблюдалась клиническая польза от снижения смертности и улучшения функции органов. EAA остается единственным анализом, одобренным FDA для измерения активности эндотоксина.
FDA США также недавно рассмотрело новую специальную заявку 510 (k) для EAA, в которой компания обновила некоторые функции анализа, в том числе точные данные в поддержку чувствительности и надежности анализа при отсечке 0,9 единиц EA.
 среда, сентября 4, 2019 at 16:58
среда, сентября 4, 2019 at 16:58